Rango de temperatura: de -20 °C a +100 °C
Rango de humedad: del 10 % al 98 % h. r.
Tamaños: volumen de 130 a 1600 litros

Controles de estabilidad ICH
La estabilidad es una de las características de calidad de un medicamento más importantes, a la par que críticas. El International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use (ICH) ha desarrollado directivas que garantizan una evaluación uniforme de la estabilidad de principios activos y medicamentos. Las autoridades farmacéuticas de todo el mundo exigen controles de estabilidad de acuerdo con la directiva Q1A (R2) de la ICH para garantizar la seguridad y eficacia de los productos farmacéuticos.
Estos controles, que pueden durar entre 12 y 60 meses, proporcionan información crucial sobre el modo en que los principios activos y los medicamentos terminados cambian a lo largo del tiempo en condiciones ambientales controladas. Por ello, las pruebas de estabilidad son un paso imprescindible en proceso de autorización para la comercialización y desempeñan un papel decisivo a la hora de autorizar un medicamento o no.
Controles de estabilidad ICH para la seguridad de los medicamentos
Las directivas Q1A de la ICH constituyen la base del control de calidad farmacéutico por medio de controles de estabilidad con base científica. Son necesarias para la autorización de comercialización y garantizan la seguridad y la eficacia de los medicamentos durante su ciclo de vida útil.
¿Cuándo se considera estable un medicamento?
Un medicamento se considera estable cuando sus propiedades químicas, físicas y microbiológicas permanecen sin cambios durante el almacenamiento y el uso por parte de los pacientes, cumpliendo así los requisitos especificados. El contenido de principio activo no debe caer por debajo de un valor determinado. Los productos de degradación solo deben producirse en cantidades mínimas dentro de ciertos límites. La liberación del principio activo de la forma farmacéutica no debe cambiar negativamente durante el almacenamiento.
Los controles de calidad ICH determinan el modo en que la calidad de un principio activo o medicamento cambia debido a la influencia de la temperatura, la humedad y la luz. Asimismo, estas pruebas sirven para determinar las condiciones y periodos de almacenamiento y uso adecuados.
Del laboratorio a la madurez comercial
El camino a la autorización de comercialización de un medicamento es un proceso estrictamente regulado. Los datos de estabilidad se protocolizan y presentan a la autoridad reguladora como parte de la solicitud de autorización de comercialización, junto con información sobre la vida útil y las condiciones de almacenamiento.
Los controles de estabilidad se realizan incluso después de obtener la autorización de comercialización, con el fin de garantizar que los criterios de estabilidad especificados se cumplen a lo largo de toda la vida útil del producto. Estos controles de calidad continuos garantizan que el medicamento conserva su eficacia y seguridad desde su desarrollo hasta su uso final.
Condiciones de prueba y parámetros

Las directivas ICH especifican las condiciones de almacenamiento, es decir, la temperatura y la humedad relativa del aire, para el almacenamiento de medicamentos para la realización de controles de estabilidad:
- Controles de estabilidad de largo plazo: almacenamiento a 25 ± 2 °C y 60 ± 5 % h. r. o 30 ± 2 °C y 65 ± 5 % h. r. durante el periodo de repetición de la prueba o hasta la fecha de caducidad propuesta para el producto para determinar o confirmar la durabilidad. El control dura al menos 12 meses y puede prolongarse hasta 60 meses.
- Controles de estabilidad intermedios: almacenamiento en condiciones que propician un incremento moderado de la velocidad de descomposición química y de las alteraciones físicas, p. ej., a 30 °C/65 % h. r. para condiciones de almacenamiento a 25 °C.
- Controles de estabilidad acelerados: almacenamiento en condiciones más adversas con el fin de aumentar la velocidad de la descomposición química o la alteración física de un principio activo o un medicamento.
Parámetros de evaluación
Durante los controles de estabilidad, se supervisan diversos parámetros, entre los que están:
- Estabilidad física: homogeneidad del medicamento
- Estabilidad química: contenido de principio activo y productos de degradación
- Estabilidad microbiológica: análisis de contaminación microbiológica
- Materiales de embalaje: interacciones entre medicamentos y envases
Realización de controles de estabilidad ICH
- Preparación de las muestras: se seleccionan lotes de medicamentos que han sido preparados e identificados para el análisis.
- Determinación de las condiciones de prueba: las condiciones de almacenamiento se definen según las directivas ICH. Las condiciones típicas de almacenamiento son:
- Pruebas de estabilidad a largo plazo a 25 °C y 60 % h.r.
- Pruebas de estabilidad aceleradas a 40 °C y 75 % h.r.
- Pruebas intermedias a 30 °C y 65 % h.r.
- Protocolo de pruebas e intervalos de tiempo: un protocolo de pruebas detallado determina en qué momentos se toman y analizan las muestras (p. ej., a los 0, 3, 6, 9, 12 meses). Si las muestras dejan de cumplir los criterios de estabilidad previamente definidos, es signo de que ya no hay estabilidad.
- Realización del control de estabilidad: las muestras se almacenan en cámaras climáticas que simulan las condiciones ambientales exactas que se han definido (temperatura y humedad relativa del aire). Se toman muestras en los puntos de control definidos y se analizan.
- Métodos analíticos: se utilizan métodos de análisis validados como la cromatografía líquida de alta resolución (CLAR), la cromatografía de gases (CG) o la espectrometría de masas (EM) para analizar las variaciones químicas y determinar el contenido de principios activos y la presencia de productos de degradación.
- Documentación: los resultados se resumen y evalúan en un informe detallado. Para ello, deben poderse trazar en todo momento las condiciones de prueba, incluso una vez finalizada la misma.
- Controles de calidad: la calibración y el mantenimiento periódicos, así como las repeticiones de pruebas garantizan que los resultados de medición sean fiables y reproducibles.
Cámaras climáticas para controles de estabilidad ICH
Los controles de estabilidad se realizan en cámaras climáticas especiales que funcionan como entornos controlados con precisión para el almacenamiento de muestras de medicamentos. Estas cámaras climáticas permiten un control preciso y la supervisión de la temperatura, la humedad relativa del aire y, en caso necesario, otros parámetros ambientales como la intensidad de la luz. La homogeneidad de los parámetros climáticos, la temperatura y la humedad del aire, es totalmente crucial, y el funcionamiento seguro y fiable de la cámara climática es imprescindible para realizar los controles de estabilidad ICH satisfactoriamente.
Entre las características más importantes de las cámaras climáticas ICH destacan:
- Condiciones climáticas precisas y homogéneas: las cámaras climáticas modernas garantizan condiciones climáticas homogéneas en el tiempo y el espacio, cumpliendo los requisitos de las directivas ICH.
- Registro automático de datos: los parámetros ajustados se protocolizan continuamente, lo que permite obtener una documentación íntegra.
- Calibración y mantenimiento periódicos: para garantizar la precisión de medición, las cámaras se validan y calibran periódicamente.
- Condiciones de prueba flexibles: Thelos equipos disponen de un amplio rango de temperatura y humedad, por lo que pueden simular diversas condiciones de almacenamiento.
Cámaras climáticas de BINDER: la mejor solución para realizar controles de estabilidad con conformidad ICH
Cámaras de clima constante
Cámaras para ensayos de fotoestabilidad
Cámaras Walk-in
Documentación de controles de estabilidad ICH
Para cumplir los requisitos regulatorios, es imprescindible poder documentar las condiciones generales de manera íntegra y totalmente trazable, así como interpretar los resultados. Esto plantea grandes exigencias a la documentación.
- Protocolo de estudio:
Antes de comenzar las pruebas, se elabora un protocolo detallado en el que se fijan todas las condiciones de ensayo, intervalos de prueba y métodos empleados. - Registro y evaluación de los datos:
Todos los resultados se documentan, desde los datos primarios hasta las evaluaciones estadísticas, pasando por los informes intermedios. Esto constituye la base para la valoración final de la estabilidad del producto. - Audit-Trail y registro electrónico de datos:
Todos los cambios en los datos se registran para generar un Audit-Trail completo. Esto garantiza la integridad y la trazabilidad de los resultados. - Informe final:
Al final de los estudios de estabilidad, se elabora un informe completo que plasma todos los resultados de prueba e incluye recomendaciones en cuanto a la vida útil y las condiciones óptimas de almacenamiento. - Conformidad regulatoria:
Toda la documentación cumple las directivas ICH y las normativas nacionales e internacionales. Esto es crucial para garantizar la autorización de comercialización y el acceso al mercado del medicamento.
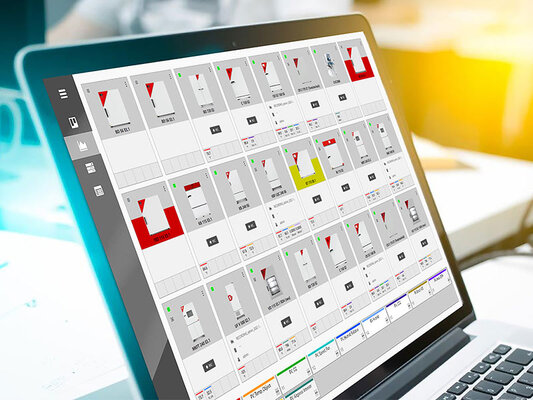
Multi Management Software APT-COM™: conformidad con la normativa y la ley
La versión BPL del Multi Management Software APT-COM™ 4 garantiza que la documentación de conformidad FDA y BPL se a prueba de manipulaciones.
Además de la sencilla vista general de equipos, dispone además de un centro de alarmas. Las alarmas de los rangos de tolerancia o los retrasos temporales, se configuran y guardan en cada equipo. Si se superan o no se alcanzan los parámetros definidos, el software lo detecta inmediatamente y el proceso afectado se destaca visualmente en la vista general de equipos.


