Plage de température : –20 °C à +100 °C
Plage d’humidité : 10 % à 98 % h.r.
Volumes : 130 à 1600 litres

Tests de stabilité ICH
La stabilité d’un médicament est simultanément l’une de ses qualités les plus importantes et les plus critiques. L’International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use (ICH) a développé des directives garantissant une évaluation uniforme de la stabilité des substances actives et des médicaments. Dans le monde entier, les autorités des médicaments exigent des tests de stabilité conformes à la directive ICH Q1A (R2) pour garantir la sécurité et l’efficacité des produits pharmaceutiques.
Ces essais, pouvant durer de 12 à 60 mois, fournissent des informations cruciales sur la manière dont les principes actifs et les médicaments définitifs évoluent au fil du temps en conditions environnementales contrôlées. Les tests de stabilité constituent donc une étape indispensable et sont décisifs dans le processus d’autorisation de mise sur le marché d’un médicament.
Tests de stabilité ICH pour des médicaments sûrs
Les directives ICH Q1A sont la base de l’assurance qualité pharmaceutique grâce aux tests de stabilité scientifiquement fondés qu’elles exigent. Ils sont nécessaires pour l’autorisation de mise sur le marché des médicaments et garantissent ainsi leur sécurité et leur efficacité tout au long de leur cycle de vie.
À quel moment un médicament est-il considéré comme stable ?
Un médicament est considéré comme stable lorsque ses propriétés chimiques, physiques et microbiologiques n’évoluent pas pendant la durée de stockage et de consommation par le patient, satisfaisant ainsi les spécifications définies. La teneur en substance active ne doit pas descendre en dessous d’une certaine valeur. De même, les produits de dégradation ne doivent être générés qu’en quantités minimales et dans les seuils définis. La libération du principe actif de la forme médicamenteuse ne doit pas être altérée pendant le stockage.
Les tests de stabilité ICH déterminer comment la qualité d’une substance active ou d’un médicament se modifie sous l’influence de la température, de l’humidité et de l’éclairage. Ils aident en outre à déterminer les conditions et les délais appropriés pour son stockage et son utilisation.
Du laboratoire à la mise sur le marché
La procédure d’autorisation de mise sur le marché d’un médicament est strictement réglementée. Les données de stabilité sont consignées et soumises à l’« Agence nationale de sécurité du médicament et des produits de santé », accompagnées d’informations sur la durée de conservation et les conditions de stockage, dans le cadre de la demande d’autorisation de mise sur le marché.
Des tests de stabilité sont également effectués après la remise de l’autorisation pour garantir que les critères de stabilité spécifiés sont respectés pendant toute la durée de conservation du produit. Ce contrôle de qualité continu garantit que les médicaments restent efficaces et sûrs, du développement à l’utilisation finale.
Conditions des tests et paramètres

Les conditions de stockage des médicaments dans le cadre du test de stabilité, c’est-à-dire la température et l’humidité relative sont définies par les directives ICH :
- Tests de stabilité à long terme : Stockage à 25 ± 2 °C et 60 ± 5 % h.r. ou 30 ± 2 °C et 65 ± 5 % h.r. pendant la période de tests répétés de la substance active ou pour la date de péremption proposée du produit, en vue de déterminer/confirmer la durée de conservation. Le test dure au moins 12 mois et jusqu’à 60 mois.
- Tests de stabilité intermédiaires : Stockage dans des conditions entraînant une augmentation modérée de la vitesse de dégradation chimique et d’altération physique, par exemple à 30 °C/65 % h.r. pour des conditions de stockage à 25 °C.
- Tests de stabilité accélérés : Stockage d’une substance active ou d’un produit en conditions renforcées, visant à augmenter la vitesse de dégradation chimique ou d’altération physique.
Paramètres d’examen
Paramètres entre autres surveillés pendant les tests de stabilité :
- Stabilité physique : Homogénéité du médicament
- Stabilité chimique : Teneur en substance active et produits de dégradation
- Stabilité microbiologique : Test de la présence de contaminants microbiologiques
- Matériaux de conditionnement : Interactions entre médicament et emballage
Procédure des tests de stabilité ICH
- Préparation de l’échantillon : Des lots de médicaments sont sélectionnés, préparés pour l’analyse et étiquetés.
- Définition des conditions de test : Les conditions de stockage sont définies conformément aux directives ICH. Conditions de stockage typiques :
- Tests de stabilité à long terme à 25 °C et 60 % h.r.
- Tests de stabilité accélérés à 40 °C et 75 % h.r.
- Tests intermédiaires à 30 °C et 65 % h.r..
- Plan de contrôle et périodes :Un plan de contrôle détaillé détermine à quels moments (par exemple après 0, 3, 6, 9 ou 12 mois) les échantillons sont prélevés et analysés. Si les échantillons ne satisfont plus les critères de stabilité préalablement définis, cela indique que la stabilité n’est plus garantie.
- Exécution du test de stabilité : Les échantillons sont stockés dans des chambres climatiques simulant précisément les conditions environnementales définies (température et humidité relative). Des échantillons sont prélevés et analysés aux moments de contrôle fixées.
- Méthodes analytiques : Des méthodes validées comme la chromatographie liquide haute performance (CLHP), la chromatographie gazeuse (CG) ou la spectrométrie de masse (SM) servent à analyser les modifications chimiques et à déterminer la teneur en substances actives ainsi que la présence de produits de dégradation.
- Documentation: Les résultats sont résumés et évalués dans un rapport détaillé. Dans ce contexte, les conditions du test doivent pouvoir être reproduites à tout moment, même après la fin de celui-ci.
- Contrôle de qualité : Un calibrage et une maintenance des appareils de mesure à intervalles réguliers ainsi que des tests répétés garantissent la fiabilité et la reproductibilité des résultats des mesures.
Chambres climatiques pour les tests de stabilité ICH
Les tests de stabilité sont réalisés dans des chambres climatiques spéciale offrant un environnement contrôlé avec précision pour le stockage des échantillons de médicaments. Ces chambres climatiques permettent de contrôler et de surveiller avec précision la température, l’humidité relative et, au besoin, d’autres paramètres environnementaux comme l’intensité lumineuse. L’homogénéité des paramètres climatiques, température et humidité, est absolument cruciale et un fonctionnement continu sûr et fiable de la chambre climatique est indispensable à la réussite des tests de stabilité ICH.
Caractéristiques essentielles des chambres climatiques ICH :
- Conditions climatiques homogènes et précises : Les chambres climatiques modernes garantissent des conditions climatiques homogènes dans le temps et dans l’espace, conformément aux directives ICH.
- Enregistrement automatique des données : Les paramètres réglés sont enregistrés en continu, ce qui permet une documentation complète.
- Calibrage et maintenance à intervalles réguliers : Les chambres sont régulièrement validées et calibrées pour garantir la précision des mesures.
- Conditions de test flexibles : Les appareils proposent une large plage de température et d’humidité et peuvent simuler différentes conditions de stockage.
Chambres climatiques BINDER – La meilleur solution pour les tests de stabilité ICH conformes aux normes
Chambres climatiques à conditions constantes
Chambres de tests de photostabilité
Chambres climatiques accessibles
Documentation des tests de stabilité ICH
Une documentation complète et compréhensible des conditions-cadres et de l’interprétation des résultats est indispensable pour satisfaire les exigences réglementaires. Cela implique des exigences en matière de documentation élevées.
- Protocole d’étude :
Avant le début des tests, un protocole détaillé est établi, définissant les conditions et les intervalles de test ainsi que les méthodes utilisées. - Collecte et évaluation des données :
Tous les résultats sont documentés : des données brutes aux rapports intermédiaires et analyses statistiques. Cette méthode constitue la base de l’évaluation finale de la stabilité du produit. - Piste d’audit et saisie électronique des données :
Les modifications de données sont enregistrées pour créer une piste d’audit complète. Cela garantit l’intégrité et la traçabilité des résultats. - Rapport final :
À la fin des études de stabilité, un rapport complet est rédigé, résumant tous les résultats des tests et contenant des recommandations concernant la durée de conservation et les conditions de stockage optimales. - Conformité réglementaire :
La documentation doit être en totalité conforme aux directives ICH et aux réglementations nationales et internationales. Ceci est décisif pour garantir l’autorisation et l’accès du médicament au marché.
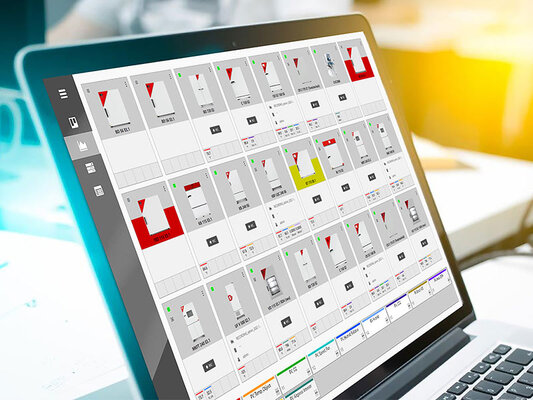
Multi Management Software APT-COM™ : conforme aux normes et juridiquement sûr
La version BPL du Multi Management Software APT-COM™ 4 garantit la documentation inviolable conforme aux exigences de la FDA et aux BPL.
En complément de la vue d’ensemble simple des appareils, elle dispose d’un centre d’alarme. Les alertes relatives aux plages de tolérance individuelles ou aux retards sont configurées et enregistrées en fonction de l’appareil. Le logiciel détecte immédiatement si les valeurs mesurées sortent des paramètres définis et met en évidence visuellement le processus concerné dans la vue d’ensemble de l’appareil.
Logiciel APT-COM™


