Temperaturbereich: -20°C bis +100°C
Feuchtebereich: 10% r.F. bis 98% r.F.
Größen: 130 bis 1600 Liter Volumen

ICH-Stabilitätsprüfungen
Die Stabilität ist eines der wichtigsten und gleichzeitig kritischsten Qualitätsmerkmale eines Arzneimittels. Der International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use (ICH) hat Richtlinien entwickelt, die eine einheitliche Bewertung der Stabilität von Wirkstoffen und Arzneimitteln gewährleisten. Weltweit fordern Arzneimittelbehörden Stabilitätsprüfungen gemäß der ICH-Richtlinie Q1A (R2), um die Sicherheit und Wirksamkeit von Pharmazeutika zu gewährleisten.
Diese Prüfungen, die zwischen 12 und 60 Monate dauern können, liefern entscheidende Informationen darüber, wie sich Wirkstoffe und Fertigarzneimittel im Lauf der Zeit unter kontrollierten Umweltbedingungen verändern. Daher sind Stabilitätsprüfungen ein unverzichtbarer Schritt im Zulassungsprozess und bestimmen maßgeblich, ob ein Arzneimittel zugelassen wird oder nicht.
ICH-Stabilitätstests für sichere Arzneimittel
Die ICH Q1A-Richtlinien bilden die Grundlage der pharmazeutischen Qualitätssicherung durch wissenschaftlich fundierte Stabilitätsprüfungen. Sie sind für die Zulassung erforderlich und garantieren damit die Sicherheit und Wirksamkeit von Medikamenten während ihres gesamten Lebenszyklus.
Wann gilt ein Arzneimittel als stabil?
Ein Arzneimittel gilt als stabil, wenn seine chemischen, physikalischen und mikrobiologischen Eigenschaften während der Lagerung und Anwendung durch den Patienten unverändert bleiben und damit den definierten Anforderungen entsprechen. Der Wirkstoffgehalt darf nicht unter einen bestimmten Wert fallen. Abbauprodukte dürfen nur in minimalen Mengen innerhalb bestimmter Grenzwerte entstehen. Die Wirkstofffreisetzung aus der Arzneiform darf sich während der Aufbewahrung nicht negativ verändern.
ICH-Stabilitätsprüfungen ermitteln, wie sich die Qualität eines Wirkstoffs oder Arzneimittels unter dem Einfluss von Temperatur, Feuchtigkeit und Licht verändert. Darüber hinaus helfen diese Tests dabei, die geeigneten Bedingungen und Zeitrahmen für Lagerung und Verwendung festzulegen.
Vom Labor zur Marktreife
Der Weg zur Zulassung eines Arzneimittels ist ein streng regulierter Prozess. Die Stabilitätsdaten werden protokolliert und zusammen mit Angaben zur Haltbarkeitsdauer und Lagerungsbedingungen als Teil des Zulassungsantrags bei der Arzneimittelbehörde eingereicht.
Auch nach der Zulassung werden Stabilitätsprüfungen durchgeführt, um sicherzustellen, dass die spezifizierten Stabilitätskriterien während der gesamten Haltbarkeitsdauer des Produktes erfüllt werden. Diese kontinuierliche Qualitätskontrolle gewährleistet, dass Arzneimittel von der Entwicklung bis zum Endverbrauch ihre Wirksamkeit und Sicherheit behalten.
Testbedingungen und Parameter

Für die Einlagerung der Arzneimittel zur Stabilitätsprüfung werden die Lagerungsbedingungen, das heißt Temperatur und relative Luftfeuchtigkeit, von den ICH-Richtlinien vorgegeben:
- Langzeit-Stabilitätsprüfungen: Lagerung bei 25 ± 2 °C und 60 ± 5 % r.F. oder 30 ± 2 °C und 65 ± 5 % r.F. für die Zeit der Wiederholungstest-Periode des Wirkstoffs oder für das vorgeschlagene Haltbarkeitsdatum des Produkts zur Ermittlung bzw. Bestätigung der Haltbarkeit. Die Prüfung dauert mindestens 12 Monate und kann bis zu 60 Monate andauern.
- Intermediäre Stabilitätsprüfungen: Lagerung unter Bedingungen, die zu einer mäßigen Erhöhung der Geschwindigkeit von chemischen Zersetzungen und physikalischen Änderungen führen, z. B. bei 30 °C/65 % r.F. für Lagerbedingungen bei 25 °C.
- Beschleunigte Stabilitätsprüfungen: Lagerung unter verschärften Lagerungsbedingungen, die darauf abzielen, die Geschwindigkeit des chemischen Abbaus oder der physikalischen Veränderung eines Wirkstoffs oder eines Arzneimittels zu erhöhen.
Untersuchungsparameter
Während der Stabilitätsprüfungen werden verschiedene Parameter überwacht, darunter:
- Physikalische Stabilität: Homogenität des Arzneimittels
- Chemische Stabilität: Wirkstoffgehalt und Abbauprodukte
- Mikrobiologische Stabilität: Prüfung auf mikrobiologische Verunreinigungen
- Verpackungsmaterialien: Wechselwirkungen zwischen Arzneimittel und Verpackung
Ablauf von ICH-Stabilitätsprüfungen
- Probenvorbereitung: Es werden Arzneimittelchargen ausgewählt, für die Analyse vorbereitet und gekennzeichnet.
- Festlegung der Testbedingungen: Die Lagerungsbedingungen werden gemäß den ICH-Richtlinien definiert.
Typische Lagerungsbedingungen sind:- Langzeit-Stabilitätsprüfungen bei 25 °C und 60 % r.F.
- Beschleunigte Stabilitätsprüfungen bei 40 °C und 75 % r.F.
- Intermediäre Tests bei 30 °C und 65 % r.F.
- Prüfplan und zeitliche Intervalle: Ein detaillierter Prüfplan legt fest, zu welchen Zeitpunkten (zum Beispiel nach 0, 3, 6, 9, 12 Monaten) die Proben entnommen und analysiert werden. Erfüllen die Proben die vorab festgelegten Stabilitätskriterien nicht mehr, ist das ein Hinweis darauf, dass die Stabilität nicht mehr gegeben ist.
- Durchführung der Stabilitätsprüfung: Die Proben werden in Klimakammern gelagert, die präzise die definierten Umweltbedingungen (Temperatur und relative Luftfeuchtigkeit) simulieren. An den festgelegten Prüfzeitpunkten werden Proben entnommen und analysiert.
- Analytische Methoden: Validierte Analysemethoden wie Hochleistungsflüssigkeitschromatographie (HPLC), Gaschromatographie (GC) oder Massenspektrometrie (MS) werden eingesetzt, um chemische Veränderungen zu analysieren und den Wirkstoffgehalt sowie das Vorhandensein von Abbauprodukten zu bestimmen.
- Dokumentation: Die Ergebnisse werden in einem detaillierten Bericht zusammengefasst und bewertet. Dabei müssen die Testbedingungen jederzeit, auch nach Beendigung der Tests, nachvollzogen werden können.
- Qualitätskontrolle: Regelmäßige Kalibrierung und Wartung der Messgeräte sowie Wiederholungstests stellen sicher, dass die Messergebnisse zuverlässig und reproduzierbar sind.
Klimakammern für ICH-Stabilitätstests
Die Stabilitätsprüfungen werden in speziellen Klimakammern durchgeführt, die als präzise kontrollierte Umgebungen für die Lagerung der Arzneimittelproben dienen. Diese Klimakammern ermöglichen die exakte Steuerung und Überwachung von Temperatur, relativer Luftfeuchtigkeit und, falls erforderlich, weiterer Umweltparameter wie Lichtintensität. Die Homogenität der Klimaparameter, Temperatur und Luftfeuchtigkeit, ist absolut entscheidend und ein sicherer und zuverlässiger Dauerbetrieb des Klimaschrankes ist unerlässlich für die erfolgreiche Durchführung von ICH-Stabilitätsprüfungen.
Zu den wichtigsten Merkmalen von ICH-Klimakammern gehören:
- Homogene Klimabedingungen: Moderne Klimakammern garantieren zeitlich und räumlich homogene Klimabedingungen, die den Vorgaben der ICH-Richtlinien entsprechen.
- Automatische Datenaufzeichnung: Die eingestellten Parameter werden kontinuierlich protokolliert und damit eine lückenlose Dokumentation ermöglicht.
- Regelmäßige Kalibrierung und Wartung: Zur Sicherstellung der Messgenauigkeit werden die Kammern regelmäßig validiert und kalibriert.
- Flexible Testumgebungen: Die Geräte verfügen über einen breiten Temperatur- und Feuchtebereich und können unterschiedliche Lagerbedingungen simulieren.
Klimakammern von BINDER – die beste Lösung für normkonforme ICH-Stabilitätsprüfungen
Konstantklimaschränke
Photostabilitätstestschränke
Walk-in-chambers
Dokumentation von ICH-Stabilitätsprüfungen
Eine lückenlose und nachvollziehbare Dokumentation der Rahmenbedingungen sowie der Interpretation der Ergebnisse ist unerlässlich, um die regulatorischen Anforderungen zu erfüllen. Dadurch werden hohe Anforderungen an die Dokumentation gestellt.
- Studienprotokoll:
Vor Beginn der Prüfungen wird ein detailliertes Protokoll erstellt, in dem alle Testbedingungen, Prüfintervalle und angewandten Methoden festgelegt sind. - Erfassung und Auswertung der Daten:
Alle Ergebnisse werden dokumentiert – von Rohdaten über Zwischenberichte bis hin zu statistischen Auswertungen. Dies bildet die Grundlage für die abschließende Bewertung der Produktstabilität. - Audit-Trail und elektronische Datenerfassung:
Sämtliche Datenänderungen werden erfasst, sodass ein lückenloser Audit-Trail entsteht. Dies gewährleistet die Integrität und Nachvollziehbarkeit der Ergebnisse. - Abschlussbericht:
Am Ende der Stabilitätsstudien wird ein umfassender Bericht erstellt, der alle Testergebnisse zusammenfasst und Empfehlungen hinsichtlich der Haltbarkeitsdauer sowie optimaler Lagerbedingungen enthält. - Regulatorische Konformität:
Die gesamte Dokumentation muss den ICH-Richtlinien sowie den nationalen und internationalen Vorschriften entsprechen. Dies ist entscheidend, um die Zulassung und den Marktzugang des Arzneimittels zu sichern.
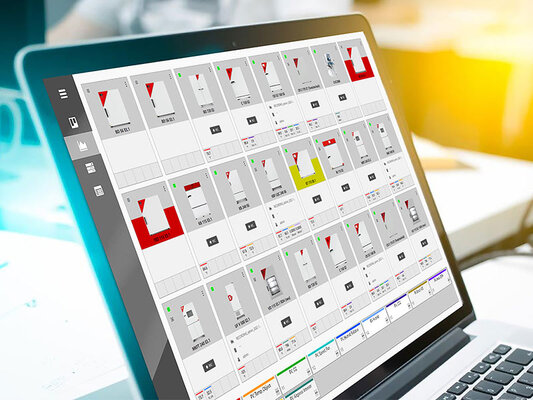
Multi Management Software APT-COM™ - normkonform und rechtssicher
Die GLP-Version der Multi Management Software APT-COM™4 garantiert die manipulationssichere FDA- und GLP-konforme Dokumentation.
Neben der einfachen Geräteübersicht verfügt sie zusätzlich über ein Alarmcenter. Alarme für individuelle Toleranzbänder oder zeitliche Verzögerungen werden gerätespezifisch konfiguriert und abgespeichert. Werden die gesetzten Parameter über- oder unterschritten, wird dies unmittelbar von der Software erkannt und der betroffene Prozess in der Geräteübersicht visuell hervorgehoben.


